- La
atracción electrostática entre átomos de diferente carga eléctrica genera un
tipo de enlace conocido como enlace iónico.
- Es necesario que para que pueda
darse dicho enlace uno se los átomos pueda ceder electrones y por el contrario
el otro pueda ganar electrones, es decir, se produce la unión entre átomos que
pasan a ser cationes y aniones. Este tipo de enlace generalmente se produce
entre un elemento metálico (electropositivo) y elemento no metálico
(electronegativo).
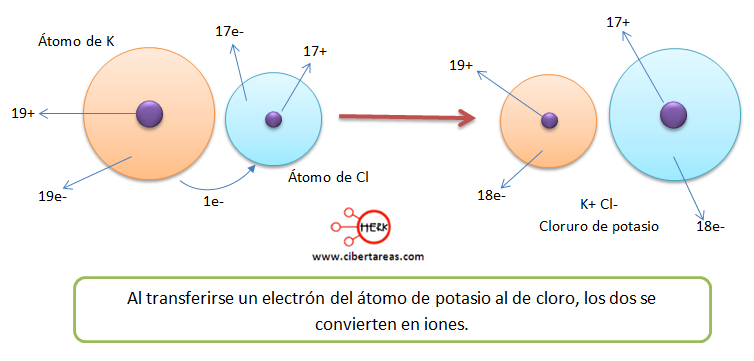
- Un ejemplo típico de este tipo de enlace lo es
el cristal iónico cloruro de sodio ( NaCl ) sal común. En
este enlace tiene lugar la transferencia de un electrón del átomo de sodio al
átomo de cloro, como se observa a continuación:Al
formarse iones de carga opuesta éstos se atraen por fuerzas eléctricas
intensas, quedando fuertemente unidos y dando lugar a un compuesto iónico.
- Estas fuerzas eléctricas las llamamos enlaces
iónicos. masivo.
Algunas
características de este tipo de enlace son:
- Sus enlaces son muy fuertes
- Son sólidos a temperatura ambiente y poseen
una estructura cristalina en el sistema cúbico.
- Altos puntos de fusión (entre
300 °C y 1000 °C) y ebullición
- Son solubles en agua y
otras disoluciones acuosas debido al dipolo eléctrico que
presentan las moléculas de agua; capaces de destruir la red.
Los iones se clasifican en dos tipos:
a) Anión:
- F- fluoruro.
- Cl- cloruro.
- Br- bromuro.
- I- yoduro.
- S 2- sulfuro.
- SO42- sulfato.
- NO3- nitrato.
- PO43- fosfato.
-
b) Catión:
- Na+ sodio.
- K+ potasio.
- Ca2+ calcio.
- Ba2+ bario.
- Mg2+ magnesio.
- Al3+ aluminio.
- Pb2+ plomo (II)
- Zn2+ zinc (o cinc)
Característica
Algunas
características de este tipo de enlace son
- Sus enlaces son muy fuertes
- .Altos puntos de fusión (entre
300 °C y 1000 °C) y ebullición
- Son solubles en agua y
otras disoluciones acuosas debido al dipolo eléctrico que
presentan las moléculas de agua; capaces de destruir la red.
- En estado sólido no conducen la
electricidad,
fuente
http://es.wikipedia.org/wiki/Enlace_i%C3%B3nico
http://dieumsnh.qfb.umich.mx/fisquimica/enlace_ionico.htm
- La atracción electrostática entre átomos de diferente carga eléctrica genera un tipo de enlace conocido como enlace iónico.
- Es necesario que para que pueda darse dicho enlace uno se los átomos pueda ceder electrones y por el contrario el otro pueda ganar electrones, es decir, se produce la unión entre átomos que pasan a ser cationes y aniones. Este tipo de enlace generalmente se produce entre un elemento metálico (electropositivo) y elemento no metálico (electronegativo).
- Un ejemplo típico de este tipo de enlace lo es el cristal iónico cloruro de sodio ( NaCl ) sal común. En este enlace tiene lugar la transferencia de un electrón del átomo de sodio al átomo de cloro, como se observa a continuación:Al formarse iones de carga opuesta éstos se atraen por fuerzas eléctricas intensas, quedando fuertemente unidos y dando lugar a un compuesto iónico.
- Estas fuerzas eléctricas las llamamos enlaces iónicos. masivo.
Algunas
características de este tipo de enlace son:
- Sus enlaces son muy fuertes
- Son sólidos a temperatura ambiente y poseen
una estructura cristalina en el sistema cúbico.
- Altos puntos de fusión (entre
300 °C y 1000 °C) y ebullición
- Son solubles en agua y
otras disoluciones acuosas debido al dipolo eléctrico que
presentan las moléculas de agua; capaces de destruir la red.
Los iones se clasifican en dos tipos:
a) Anión:
- F- fluoruro.
- Cl- cloruro.
- Br- bromuro.
- I- yoduro.
- S 2- sulfuro.
- SO42- sulfato.
- NO3- nitrato.
- PO43- fosfato.
b) Catión:
- Na+ sodio.
- K+ potasio.
- Ca2+ calcio.
- Ba2+ bario.
- Mg2+ magnesio.
- Al3+ aluminio.
- Pb2+ plomo (II)
- Zn2+ zinc (o cinc)
Característica
Algunas
características de este tipo de enlace son
- Sus enlaces son muy fuertes
- .Altos puntos de fusión (entre
300 °C y 1000 °C) y ebullición
- Son solubles en agua y
otras disoluciones acuosas debido al dipolo eléctrico que
presentan las moléculas de agua; capaces de destruir la red.
- En estado sólido no conducen la
electricidad,
No hay comentarios:
Publicar un comentario